- ZÉOLITES
- ZÉOLITESLe terme zéolite, retrouvé pour la première fois dans la littérature scientifique du XVIIIe siècle, est dérivé des deux mots grecs zein (bouillir) et lithos (pierre). L’origine de cette désignation reposait sur l’observation faite par le baron A. F. Cronstedt que, pendant un chauffage rapide, certains minéraux semblaient fondre et bouillir en même temps, en dégageant une quantité énorme de vapeur d’eau. Ce phénomène d’intumescence pouvait en outre être répété après l’exposition du minéral à l’air humide. Pendant cette même période, il a été découvert que ces zéolites naturelles étaient utilisables dans l’adoucissement des eaux dures et, par conséquent, avaient des propriétés d’échangeur de cations.C’est seulement à partir de 1920 qu’on a mis en évidence le fait que ces matériaux étaient capables d’absorber des vapeurs organiques. On s’est également rendu compte que certaines de ces zéolites naturelles pouvaient fonctionner comme de véritables tamis de molécules, d’où leur nom générique de tamis moléculaire . Et même, la chabasie, un minéral appartenant à la famille des zéolites naturelles, est capable dans sa forme déshydratée, de «sorber» rapidement des vapeurs alcooliques, tandis que d’autres molécules organiques d’une taille plus grosse (comme le benzène et l’acétone) ne sont pas acceptées par cette structure.L’étude systématique des zéolites naturelles et de leurs propriétés, comme tamis moléculaire et échangeur de cations, a été commencée par R. M. Barrer et ses collaborateurs vers 1930. De plus, cette même équipe de chercheurs a préparé pour la première fois des zéolites synthétiques. Depuis lors, toutes les grandes compagnies chimiques et pétrolières ont eu des activités dans ce domaine et ne cessent de déposer des brevets sur la préparation et les applications de zéolites nouvelles. Jusqu’à présent, toutes les zéolites naturelles ont été synthétisées, et, en outre, plusieurs nouvelles zéolites synthétiques, dont la structure n’existe pas dans la nature, sont connues. Entre-temps, toute une gamme de zéolites synthétiques a trouvé des applications industrielles comme échangeur de cations, tamis moléculaire, catalyseur et épurateur chimiques. En 1983, l’étude des zéolites est un domaine scientifique et industriel en plein développement.1. Structure des zéolitesChimiquement, les zéolites (naturelles ou synthétiques) sont des aluminosilicates hydratés de composition
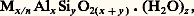 M étant un cation échangeable de valence n et (H2O)z représentant l’eau d’hydratation. Leur structure, ou leur réseau cristallin, est constituée par des enchaînements tridimensionnels de tétraèdres Si4 et A1-4 liés par leurs sommets. Les cations M, neutralisant les charges négatives des tétraèdres A1-4, peuvent être échangés par d’autres cations, au contact d’une solution saline appropriée.La charpente d’aluminosilicate, formée par ces enchaînements tridimensionnels, délimite un espace vacant. Cet espace est organisé en un réseau complexe de pores, cages et cavités. Les molécules d’eau occupant normalement ce réseau poreux peuvent être remplacées par des molécules de taille inférieure à la dimension des pores. Certaines zéolites peuvent aussi être synthétisées avec d’autres tétraèdres (comme GeO4, Ga-4 et P+4) qui se substituent partiellement ou complètement aux tétraèdres Si4 et/ou A1-4. Pour une même structure, ceci peut provoquer des changements dans les dimensions des pores et des cages.Les chaînes de tétraèdres forment des arrangements caractéristiques, soit des anneaux, soit des polyèdres, qui se retrouvent dans plusieurs types de zéolites. On classe donc dans un même groupe les zéolites présentant un motif structural donné. Ainsi, la classification en 7 groupes de W. M. Meier est basée sur les motifs représentés sur la figure 1. La charpente de quelques zéolites utilisées industriellement est visualisée sur la figure 2. Les micropores zéolitiques peuvent alors avoir une structure et une géométrie distinctes. Le système poreux peut être mono-, di- ou tridimensionnel, composé de pores droites, ondulaires ou même formé par des cages avec des fenêtres communes. Cette structure détermine les propriétés spécifiques comme tamis moléculaire et catalyseur sélectif.2. Zéolites synthétiquesLes zéolites naturelles ont été trouvées dans des roches basaltiques ou dans des sédiments comme produits d’altération. Elles s’y forment selon un processus hydrothermal qui a été étudié et reproduit en vue d’obtenir des variétés synthétiques. La synthèse hydrothermale consiste en la cristallisation d’une zéolite à partir d’un mélange ternaire contenant l’eau comme solvant, un aluminosilicate solide comme substance nutritive et un agent minéralisant. Le composé aluminosilicate, dans ce milieu réactionnel de bases fortes, se dissout et se réorganise. Ensuite des germes se forment, éventuellement après une période d’induction; cette période de germination est suivie par une période de croissance des germes.La réaction de cristallisation de zéolites par la méthode hydrothermale a souvent été rationalisée comme un phénomène autocatalytique, dépendant de la température et de l’alcalinité du milieu réactionnel. Jusqu’à présent, le rôle respectif des phases solides et liquides n’est pas connu. Par ailleurs, il est certain que la nature des cations et leur concentration jouent un rôle prépondérant. Ces cations interviennent dans la cristallisation comme source de basicité; ils stabilisent de façon spécifique la formation de certaines unités structurales et déterminent ainsi la formation d’une structure particulière.Dans les études récentes, on attache beaucoup d’importance à l’emploi de bases organiques dans les mélanges d’alcalis. Cette méthode a permis d’obtenir un grand nombre de nouvelles espèces zéolitiques riches en Si2, avec une stabilité thermique remarquable et d’intéressantes propriétés adsorbantes et catalytiques. En outre, l’addition de bases organiques a permis de synthétiser des «polymorphes» de Si2 avec la charpente zéolithique: la silicalite, qui a été synthétisée par cette méthode, a une structure très proche de celle de la zéolite ZSM-5, mais ne contient pas d’aluminium et, par conséquent, ne contient pas non plus de cations échangeables dans le réseau.Des zéolites peuvent aussi être synthétisées à partir de substrats réactifs autres que les gels d’aluminosilicates, comme des verres volcaniques pulvérisés, ou des minéraux argileux (par exemple, la kaolinite, le métakaolin et la montmorillonite). Il en résulte qu’une variation d’un paramètre peut modifier les pseudo-équilibres et entraîner la formation d’une nouvelle zéolite.3. Propriétés zéolitiques et applicationsLes zéolites sont utilisées dans l’industrie comme échangeurs de cations, adsorbants sélectifs et catalyseurs.Échangeurs de cationsChaque fois qu’un ion Si4+ est substitué dans le réseau zéolitique par un ion A13+, une charge négative est créée qui doit être compensée par des cations échangeables. Le nombre d’ions échangeables détermine la capacité d’échange de cations (C.E.C.). Les zéolites, les plus riches en aluminium dans le réseau, ont une C.E.C. plus élevée.Toutes les applications comme échangeur cationique sont basées sur un phénomène de sélectivité: chaque zéolite est capable de fixer certains éléments chimiques dans ses pores ou cages. Les lieux de fixation sont dénommés sites cationiques. La zéolite est même capable de retirer certains cations de leurs solutions aqueuses très diluées et de les fixer d’une façon irréversible. Les applications des zéolites basées sur leurs propriétés d’échangeur cationique sont présentées dans le tableau 1.Tamis moléculaires ou adsorbantsLes propriétés adsorbantes particulières des zéolites sont déterminées par: la sélectivité dimensionnelle, la capacité et l’énergie d’adsorption, l’hydrophobicité.L’espace vide dans une zéolite est constitué par les dimensions de ses pores et cages qui conduisent à la sélectivité dimensionnelle . Vis-à-vis des molécules, le réseau zéolitique fonctionne comme un tamis ordinaire à l’égard d’une poudre solide, d’où le nom générique de tamis moléculaire donné aux zéolites utilisées comme adsorbants. Le diamètre des pores, et des cages communiquant entre elles par des fenêtres, est fixé pour une structure donnée; mais il peut encore être modifié par la taille et le nombre des cations présents. Une zéolite A, échangée aux ions K+, Na+ ou Ca2+, a comme diamètre des fenêtres: 0,3, 0,4 et 0,5 nanomètre respectivement. Les propriétés de quelques zéolites, relatives à leur utilisation comme tamis moléculaire, sont fournies dans le tableau 2.La capacité d’adsorption est déterminée par la densité du matériau; celle-ci est d’autant plus faible que la microporosité de la zéolite, et par conséquent sa capacité d’adsorption, est plus élevée.L’énergie d’adsorption est la chaleur dégagée quand une molécule est fixée dans les pores zéolitiques. Celle-ci détermine la force de l’adsorption; c’est une mesure de l’énergie nécessaire pour «désorber» l’adsorbat. En raison du caractère ionique des zéolites, l’énergie d’adsorption sur ces corps par rapport à celle du solide non ionique (comme le carbone) comportera une contribution supplémentaire due aux interactions dipolaires entre les cations et les molécules adsorbées.Quant à l’hydrophobicité enfin, il est connu que les zéolites riches en silicium, et donc avec une C.E.C. très faible, se comportent comme des solides hydrophobes; elles vont donc rejeter des molécules d’eau de leurs pores. Ces solides (comme la silicalite) sont utilisés pour épurer des eaux contaminées par des molécules organiques.À titre d’adsorbants, les zéolites ont des applications très importantes.Le séchage des fluides est une des applications les plus répandues. Les tamis moléculaires (surtout la zéolite A) fixent énergiquement l’eau jusqu’à saturation. Les colonnes de tamis sont régénérables par simple chauffage jusqu’à 300 0C. Les applications spécifiques sont le séchage de liquides frigorifiques, d’huiles, ou de liquides diélectriques pour transformateurs; le séchage d’oléfines légers destinés à la polymérisation ou d’hydrogène pour des réactions chimiques ou bien métallurgiques; le séchage des gaz caloporteurs des piles nucléaires.La séparation d’hydrocarbures , qui est basée sur l’effet de tamisage, fournit une série d’applications pour l’élimination des n -paraffines d’un mélange d’hydrocarbures; pour la séparation d’oléfines d’autres hydrocarbures; pour la séparation du para-xylène (produit de base pour la production de polyesters) d’un mélange de ses isomères. Les procédés industriels les plus connus dans ce domaine sont: Isosiv et Oléfin Siv (Union Carbide), Molex, Olex et Parex (U.O.P.-Universal Oil Products). Outre ces applications de grande échelle, les zéolites sont aussi utilisées pour le garnissage de colonnes de chromatographie en phase gazeuse.La purification des fluides permet d’obtenir:– la dépollution de gaz naturels et industriels; les procédés Union Carbide: Pura Siv Hg, Pura Siv N et Pura Siv S sont utilisés pour éliminer des vapeurs de mercure, NOx et S2 respectivement;– la purification de l’air avant liquéfaction puisque les composés qui se condenseraient sont d’abord éliminés (comme CO2 et H2O);– l’enrichissement d’air en oxygène; en effet, comme l’oxygène est adsorbé préférentiellement à l’azote sur des tamis moléculaires de types A et X, ils sont utilisés à moyenne échelle (20 tonnes par jour) dans le traitement oxygénant d’eaux polluées, le blanchissement de pâte à papier et le traitement de refusion en sidérurgie.D’autres applications spécifiques de stockage existent aussi.Comme système de stockage de gaz, on utilise la propriété suivante: dans les zéolites, par exemple du type A, certains gaz comme l’hydrogène et le méthane peuvent pénétrer dans les cages sous des conditions de température et de pression élevées et, après, y rester à la température ambiante et sous pression atmosphérique.Le stockage de produits chimiques réactifs est également rendu possible car, dans la fabrication de caoutchoucs et de résines synthétiques, des zéolites (du type X) peuvent adsorber et isoler des réactifs instables jusqu’au moment de leur utilisation.Enfin, comme agent d’«encapsulation» dans l’industrie nucléaire, la zéolite sodalite est utilisée pour stocker du kripton radioactif (85Kr), formé pendant l’activation de l’uranium usé. L’iode radioactif, produit des réacteurs nucléaires, peut être fixé d’une façon irréversible par des zéolites X, échangées aux ions d’argent.CatalyseursIl est généralement admis que les propriétés acides , très prononcées, des zéolites sont à l’origine de leur activité. Des sites acides de Brønsted (c’est-à-dire ceux qui donnent des protons à un substrat basique) peuvent être créés par échange des cations initialement présents avec le proton d’un acide ou avec le cation ammonium qui se décompose par calcination formant ainsi le proton sur la surface, et par hydrolyse des cations présents dans la zéolite quand cette dernière est déshydratée à température élevée. Les meilleurs catalyseurs acides devraient être les zéolites ayant une capacité d’échange élevée et, par conséquent, avec de très nombreux sites acides. En réalité, la densité des sites et l’action polarisante du champ électrique dans les pores interviennent fortement dans la détermination de la réactivité des catalyseurs zéolitiques.Une seconde particularité de la catalyse zéolitique résulte de la géométrie des pores qui ont à peu près les dimensions moléculaires. De ceci découle le tamisage moléculaire ou la sélectivité de forme . Cela englobe des effets géométriques et des effets de diffusion dans les pores.La zéolite peut aussi servir de support de métaux de transition. Après réduction des cations métalliques, une très grande dispersion des métaux dans les cages et/ou les pores peut être obtenue; cela leur donne une activité excellente d’hydrogénation et de déshydrogénation. Cette présence de trois fonctions catalytiques est souhaitable pour la réalisation de catalyseurs multifonctionnels . Ces propriétés spécifiques des zéolites sont utilisées surtout dans le domaine de la pétrochimie et trouvent une application dans de nombreux procédés.Le cracking catalytique est la plus importante utilisation des zéolites en catalyse; il a pour but de produire, à partir des gasoils dont les points d’ébullition s’échelonnent de 200 à 600 0C environ, une plus grande quantité de carburant à indice d’octane élevé. L’utilisation des catalyseurs zéolitiques a permis d’obtenir des performances considérablement améliorées par rapport aux anciens catalyseurs. Elle a non seulement bouleversé la technologie des unités, mais donne aussi des gains considérables de conversion et de rendement en essence. Plus de 90 p. 100 des installations de cracking dans le monde fonctionnent avec les catalyseurs zéolitiques. Ces catalyseurs zéolitiques sont constitués de 3 à 30 p. 100 en poids de zéolite dispersée dans une matrice amorphe d’oxyde ou d’argile. La zéolite doit être très ouverte dans sa forme acide et posséder une résistance thermale et hydrothermale. Une zéolite X ou Y échangée aux ions multivalents comme les terres rares ou une zéolite «Y Ultrastable» possèdent toutes ces qualités. La matrice amorphe doit surtout donner au catalyseur sa solidité physique, nécessaire pour avoir une résistance contre l’abrasion quand il est utilisé dans un réacteur F.C.C. (Fluid Cracking Catalyst) où le cracking se fait dans un lit fluidisé. Dans un tel réacteur, l’ensemble de la charge et du catalyseur se comporte comme un fluide et satisfait aux lois de l’hydrodynamique. Il est composé d’une unité de conversion et de régénération. Avec les catalyseurs zéolitiques actifs, le cracking se fait surtout dans la zone de transfert (riser ) entre les deux unités; et le procédé est connu sous le nom de «riser cracking». Reste à noter que quelques parties pour mille de platine, échangées dans la zéolite, réduisent d’une façon efficace la teneur en monoxyde de carbone dans les fumées issues du régénérateur.L’hydro- isomérisation : l’indice d’octane d’une essence peut être augmenté en isomérisant les hydrocarbures n -pentane (n -C5) et n -hexane (n -C6) dans leurs isomères branchés. D’abord, la coupe n -C5 et n -C6 est séparée d’une essence sortant d’une unité de cracking par un procédé Isosiv, et ensuite elle est isomérisée par un procédé Hysomer. Les catalyseurs utilisés sont des zéolites Y ou mordénite, dans la forme acide et contenant un métal noble finement dispersé dans la structure. L’indice d’octane des produits est de l’ordre de 90.L’hydrocracking : le cracking hydrogénant sur un catalyseur zéolitique du type Y contenant à peu près 0,5 p. 100 en poids de métaux nobles comme le platine peut convertir des coupes de pétrole inférieures en tels ou tels produits selon les besoins et les prix. Il est possible d’obtenir, en variant très peu la température du réacteur, soit des charges aromatiques pour l’industrie chimique et pour la fabrication de polymères, soit des carburants pour moteur d’avion et moteur Diesel, soit des fuels domestiques. Environ 1 500 000 barrils (1 barril = 158,98 l) de pétrole brut par jour sont traités de cette façon.Le selectoforming : certaines zéolites, n’admettant que les n -paraffines dans leurs pores, comme l’érionite, et certaines zéolites ZSM sont utilisées pour éliminer ces hydrocarbures linéaires des essences et des huiles. Les catalyseurs sont acides et contiennent des métaux nobles. Le procédé est utilisé pour augmenter l’indice d’octane d’une essence de 2 à 10 points par transformation des n -paraffines en produits gazeux (coupe L.P.G.: Liquid Petroleum Gaz), ou pour déparaffiner des huiles de graissage ou encore des carburants pour moteur Diesel surtout en hiver.La conversion de charbon et gaz naturel en essence par le procédé Mobil M : la zéolite ZSM-5 dans sa forme acide permet de transformer le méthanol (CH3OH) en essence d’indice d’octane élevé. En combinant ce catalyseur avec des procédés classiques, il est possible de transformer le gaz naturel et/ou le charbon soit en essence, soit en oléfines légères pour l’industrie chimique, soit en gasoil. Bien que le prix des produits soit encore plus élevé que celui des mêmes produits obtenus par voie classique, l’existence de ces procédés a diminué la dépendance de beaucoup de pays industriels des pays exportateurs de pétrole.Enfin, la zéolite ZSM-5 dans sa forme acide est utilisée dans le procédé Mobil-Badger pour la production de l’éthylbenzène , produit intermédiaire dans la fabrication du styrène. Utilisant ce même catalyseur, le para-xylène, produit de base dans la fabrication de polyesters, peut être produit. Les propriétés caractéristiques de ces procédés sont leurs rendements élevés, leurs produits purs, l’absence de corrosion des matériaux et de pollution de l’environnement. À l’aide de la zéolite ZSM-5, les compagnies Mobil et Hoechst ont réussi à fabriquer un nouveau monomère: le para-méthylstyrène (PMS). Son polymère, le polypara-méthylstyrène (PPMS), a des qualités supérieures à celles du polystyrène.L’obtention des analogues synthétiques des zéolites naturelles et la découverte de nouvelles zéolites ont permis le développement récent d’études systématiques. Leurs propriétés caractéristiques sont si intéressantes qu’elles conduisent à une utilisation accrue des zéolites dans le domaine industriel.
M étant un cation échangeable de valence n et (H2O)z représentant l’eau d’hydratation. Leur structure, ou leur réseau cristallin, est constituée par des enchaînements tridimensionnels de tétraèdres Si4 et A1-4 liés par leurs sommets. Les cations M, neutralisant les charges négatives des tétraèdres A1-4, peuvent être échangés par d’autres cations, au contact d’une solution saline appropriée.La charpente d’aluminosilicate, formée par ces enchaînements tridimensionnels, délimite un espace vacant. Cet espace est organisé en un réseau complexe de pores, cages et cavités. Les molécules d’eau occupant normalement ce réseau poreux peuvent être remplacées par des molécules de taille inférieure à la dimension des pores. Certaines zéolites peuvent aussi être synthétisées avec d’autres tétraèdres (comme GeO4, Ga-4 et P+4) qui se substituent partiellement ou complètement aux tétraèdres Si4 et/ou A1-4. Pour une même structure, ceci peut provoquer des changements dans les dimensions des pores et des cages.Les chaînes de tétraèdres forment des arrangements caractéristiques, soit des anneaux, soit des polyèdres, qui se retrouvent dans plusieurs types de zéolites. On classe donc dans un même groupe les zéolites présentant un motif structural donné. Ainsi, la classification en 7 groupes de W. M. Meier est basée sur les motifs représentés sur la figure 1. La charpente de quelques zéolites utilisées industriellement est visualisée sur la figure 2. Les micropores zéolitiques peuvent alors avoir une structure et une géométrie distinctes. Le système poreux peut être mono-, di- ou tridimensionnel, composé de pores droites, ondulaires ou même formé par des cages avec des fenêtres communes. Cette structure détermine les propriétés spécifiques comme tamis moléculaire et catalyseur sélectif.2. Zéolites synthétiquesLes zéolites naturelles ont été trouvées dans des roches basaltiques ou dans des sédiments comme produits d’altération. Elles s’y forment selon un processus hydrothermal qui a été étudié et reproduit en vue d’obtenir des variétés synthétiques. La synthèse hydrothermale consiste en la cristallisation d’une zéolite à partir d’un mélange ternaire contenant l’eau comme solvant, un aluminosilicate solide comme substance nutritive et un agent minéralisant. Le composé aluminosilicate, dans ce milieu réactionnel de bases fortes, se dissout et se réorganise. Ensuite des germes se forment, éventuellement après une période d’induction; cette période de germination est suivie par une période de croissance des germes.La réaction de cristallisation de zéolites par la méthode hydrothermale a souvent été rationalisée comme un phénomène autocatalytique, dépendant de la température et de l’alcalinité du milieu réactionnel. Jusqu’à présent, le rôle respectif des phases solides et liquides n’est pas connu. Par ailleurs, il est certain que la nature des cations et leur concentration jouent un rôle prépondérant. Ces cations interviennent dans la cristallisation comme source de basicité; ils stabilisent de façon spécifique la formation de certaines unités structurales et déterminent ainsi la formation d’une structure particulière.Dans les études récentes, on attache beaucoup d’importance à l’emploi de bases organiques dans les mélanges d’alcalis. Cette méthode a permis d’obtenir un grand nombre de nouvelles espèces zéolitiques riches en Si2, avec une stabilité thermique remarquable et d’intéressantes propriétés adsorbantes et catalytiques. En outre, l’addition de bases organiques a permis de synthétiser des «polymorphes» de Si2 avec la charpente zéolithique: la silicalite, qui a été synthétisée par cette méthode, a une structure très proche de celle de la zéolite ZSM-5, mais ne contient pas d’aluminium et, par conséquent, ne contient pas non plus de cations échangeables dans le réseau.Des zéolites peuvent aussi être synthétisées à partir de substrats réactifs autres que les gels d’aluminosilicates, comme des verres volcaniques pulvérisés, ou des minéraux argileux (par exemple, la kaolinite, le métakaolin et la montmorillonite). Il en résulte qu’une variation d’un paramètre peut modifier les pseudo-équilibres et entraîner la formation d’une nouvelle zéolite.3. Propriétés zéolitiques et applicationsLes zéolites sont utilisées dans l’industrie comme échangeurs de cations, adsorbants sélectifs et catalyseurs.Échangeurs de cationsChaque fois qu’un ion Si4+ est substitué dans le réseau zéolitique par un ion A13+, une charge négative est créée qui doit être compensée par des cations échangeables. Le nombre d’ions échangeables détermine la capacité d’échange de cations (C.E.C.). Les zéolites, les plus riches en aluminium dans le réseau, ont une C.E.C. plus élevée.Toutes les applications comme échangeur cationique sont basées sur un phénomène de sélectivité: chaque zéolite est capable de fixer certains éléments chimiques dans ses pores ou cages. Les lieux de fixation sont dénommés sites cationiques. La zéolite est même capable de retirer certains cations de leurs solutions aqueuses très diluées et de les fixer d’une façon irréversible. Les applications des zéolites basées sur leurs propriétés d’échangeur cationique sont présentées dans le tableau 1.Tamis moléculaires ou adsorbantsLes propriétés adsorbantes particulières des zéolites sont déterminées par: la sélectivité dimensionnelle, la capacité et l’énergie d’adsorption, l’hydrophobicité.L’espace vide dans une zéolite est constitué par les dimensions de ses pores et cages qui conduisent à la sélectivité dimensionnelle . Vis-à-vis des molécules, le réseau zéolitique fonctionne comme un tamis ordinaire à l’égard d’une poudre solide, d’où le nom générique de tamis moléculaire donné aux zéolites utilisées comme adsorbants. Le diamètre des pores, et des cages communiquant entre elles par des fenêtres, est fixé pour une structure donnée; mais il peut encore être modifié par la taille et le nombre des cations présents. Une zéolite A, échangée aux ions K+, Na+ ou Ca2+, a comme diamètre des fenêtres: 0,3, 0,4 et 0,5 nanomètre respectivement. Les propriétés de quelques zéolites, relatives à leur utilisation comme tamis moléculaire, sont fournies dans le tableau 2.La capacité d’adsorption est déterminée par la densité du matériau; celle-ci est d’autant plus faible que la microporosité de la zéolite, et par conséquent sa capacité d’adsorption, est plus élevée.L’énergie d’adsorption est la chaleur dégagée quand une molécule est fixée dans les pores zéolitiques. Celle-ci détermine la force de l’adsorption; c’est une mesure de l’énergie nécessaire pour «désorber» l’adsorbat. En raison du caractère ionique des zéolites, l’énergie d’adsorption sur ces corps par rapport à celle du solide non ionique (comme le carbone) comportera une contribution supplémentaire due aux interactions dipolaires entre les cations et les molécules adsorbées.Quant à l’hydrophobicité enfin, il est connu que les zéolites riches en silicium, et donc avec une C.E.C. très faible, se comportent comme des solides hydrophobes; elles vont donc rejeter des molécules d’eau de leurs pores. Ces solides (comme la silicalite) sont utilisés pour épurer des eaux contaminées par des molécules organiques.À titre d’adsorbants, les zéolites ont des applications très importantes.Le séchage des fluides est une des applications les plus répandues. Les tamis moléculaires (surtout la zéolite A) fixent énergiquement l’eau jusqu’à saturation. Les colonnes de tamis sont régénérables par simple chauffage jusqu’à 300 0C. Les applications spécifiques sont le séchage de liquides frigorifiques, d’huiles, ou de liquides diélectriques pour transformateurs; le séchage d’oléfines légers destinés à la polymérisation ou d’hydrogène pour des réactions chimiques ou bien métallurgiques; le séchage des gaz caloporteurs des piles nucléaires.La séparation d’hydrocarbures , qui est basée sur l’effet de tamisage, fournit une série d’applications pour l’élimination des n -paraffines d’un mélange d’hydrocarbures; pour la séparation d’oléfines d’autres hydrocarbures; pour la séparation du para-xylène (produit de base pour la production de polyesters) d’un mélange de ses isomères. Les procédés industriels les plus connus dans ce domaine sont: Isosiv et Oléfin Siv (Union Carbide), Molex, Olex et Parex (U.O.P.-Universal Oil Products). Outre ces applications de grande échelle, les zéolites sont aussi utilisées pour le garnissage de colonnes de chromatographie en phase gazeuse.La purification des fluides permet d’obtenir:– la dépollution de gaz naturels et industriels; les procédés Union Carbide: Pura Siv Hg, Pura Siv N et Pura Siv S sont utilisés pour éliminer des vapeurs de mercure, NOx et S2 respectivement;– la purification de l’air avant liquéfaction puisque les composés qui se condenseraient sont d’abord éliminés (comme CO2 et H2O);– l’enrichissement d’air en oxygène; en effet, comme l’oxygène est adsorbé préférentiellement à l’azote sur des tamis moléculaires de types A et X, ils sont utilisés à moyenne échelle (20 tonnes par jour) dans le traitement oxygénant d’eaux polluées, le blanchissement de pâte à papier et le traitement de refusion en sidérurgie.D’autres applications spécifiques de stockage existent aussi.Comme système de stockage de gaz, on utilise la propriété suivante: dans les zéolites, par exemple du type A, certains gaz comme l’hydrogène et le méthane peuvent pénétrer dans les cages sous des conditions de température et de pression élevées et, après, y rester à la température ambiante et sous pression atmosphérique.Le stockage de produits chimiques réactifs est également rendu possible car, dans la fabrication de caoutchoucs et de résines synthétiques, des zéolites (du type X) peuvent adsorber et isoler des réactifs instables jusqu’au moment de leur utilisation.Enfin, comme agent d’«encapsulation» dans l’industrie nucléaire, la zéolite sodalite est utilisée pour stocker du kripton radioactif (85Kr), formé pendant l’activation de l’uranium usé. L’iode radioactif, produit des réacteurs nucléaires, peut être fixé d’une façon irréversible par des zéolites X, échangées aux ions d’argent.CatalyseursIl est généralement admis que les propriétés acides , très prononcées, des zéolites sont à l’origine de leur activité. Des sites acides de Brønsted (c’est-à-dire ceux qui donnent des protons à un substrat basique) peuvent être créés par échange des cations initialement présents avec le proton d’un acide ou avec le cation ammonium qui se décompose par calcination formant ainsi le proton sur la surface, et par hydrolyse des cations présents dans la zéolite quand cette dernière est déshydratée à température élevée. Les meilleurs catalyseurs acides devraient être les zéolites ayant une capacité d’échange élevée et, par conséquent, avec de très nombreux sites acides. En réalité, la densité des sites et l’action polarisante du champ électrique dans les pores interviennent fortement dans la détermination de la réactivité des catalyseurs zéolitiques.Une seconde particularité de la catalyse zéolitique résulte de la géométrie des pores qui ont à peu près les dimensions moléculaires. De ceci découle le tamisage moléculaire ou la sélectivité de forme . Cela englobe des effets géométriques et des effets de diffusion dans les pores.La zéolite peut aussi servir de support de métaux de transition. Après réduction des cations métalliques, une très grande dispersion des métaux dans les cages et/ou les pores peut être obtenue; cela leur donne une activité excellente d’hydrogénation et de déshydrogénation. Cette présence de trois fonctions catalytiques est souhaitable pour la réalisation de catalyseurs multifonctionnels . Ces propriétés spécifiques des zéolites sont utilisées surtout dans le domaine de la pétrochimie et trouvent une application dans de nombreux procédés.Le cracking catalytique est la plus importante utilisation des zéolites en catalyse; il a pour but de produire, à partir des gasoils dont les points d’ébullition s’échelonnent de 200 à 600 0C environ, une plus grande quantité de carburant à indice d’octane élevé. L’utilisation des catalyseurs zéolitiques a permis d’obtenir des performances considérablement améliorées par rapport aux anciens catalyseurs. Elle a non seulement bouleversé la technologie des unités, mais donne aussi des gains considérables de conversion et de rendement en essence. Plus de 90 p. 100 des installations de cracking dans le monde fonctionnent avec les catalyseurs zéolitiques. Ces catalyseurs zéolitiques sont constitués de 3 à 30 p. 100 en poids de zéolite dispersée dans une matrice amorphe d’oxyde ou d’argile. La zéolite doit être très ouverte dans sa forme acide et posséder une résistance thermale et hydrothermale. Une zéolite X ou Y échangée aux ions multivalents comme les terres rares ou une zéolite «Y Ultrastable» possèdent toutes ces qualités. La matrice amorphe doit surtout donner au catalyseur sa solidité physique, nécessaire pour avoir une résistance contre l’abrasion quand il est utilisé dans un réacteur F.C.C. (Fluid Cracking Catalyst) où le cracking se fait dans un lit fluidisé. Dans un tel réacteur, l’ensemble de la charge et du catalyseur se comporte comme un fluide et satisfait aux lois de l’hydrodynamique. Il est composé d’une unité de conversion et de régénération. Avec les catalyseurs zéolitiques actifs, le cracking se fait surtout dans la zone de transfert (riser ) entre les deux unités; et le procédé est connu sous le nom de «riser cracking». Reste à noter que quelques parties pour mille de platine, échangées dans la zéolite, réduisent d’une façon efficace la teneur en monoxyde de carbone dans les fumées issues du régénérateur.L’hydro- isomérisation : l’indice d’octane d’une essence peut être augmenté en isomérisant les hydrocarbures n -pentane (n -C5) et n -hexane (n -C6) dans leurs isomères branchés. D’abord, la coupe n -C5 et n -C6 est séparée d’une essence sortant d’une unité de cracking par un procédé Isosiv, et ensuite elle est isomérisée par un procédé Hysomer. Les catalyseurs utilisés sont des zéolites Y ou mordénite, dans la forme acide et contenant un métal noble finement dispersé dans la structure. L’indice d’octane des produits est de l’ordre de 90.L’hydrocracking : le cracking hydrogénant sur un catalyseur zéolitique du type Y contenant à peu près 0,5 p. 100 en poids de métaux nobles comme le platine peut convertir des coupes de pétrole inférieures en tels ou tels produits selon les besoins et les prix. Il est possible d’obtenir, en variant très peu la température du réacteur, soit des charges aromatiques pour l’industrie chimique et pour la fabrication de polymères, soit des carburants pour moteur d’avion et moteur Diesel, soit des fuels domestiques. Environ 1 500 000 barrils (1 barril = 158,98 l) de pétrole brut par jour sont traités de cette façon.Le selectoforming : certaines zéolites, n’admettant que les n -paraffines dans leurs pores, comme l’érionite, et certaines zéolites ZSM sont utilisées pour éliminer ces hydrocarbures linéaires des essences et des huiles. Les catalyseurs sont acides et contiennent des métaux nobles. Le procédé est utilisé pour augmenter l’indice d’octane d’une essence de 2 à 10 points par transformation des n -paraffines en produits gazeux (coupe L.P.G.: Liquid Petroleum Gaz), ou pour déparaffiner des huiles de graissage ou encore des carburants pour moteur Diesel surtout en hiver.La conversion de charbon et gaz naturel en essence par le procédé Mobil M : la zéolite ZSM-5 dans sa forme acide permet de transformer le méthanol (CH3OH) en essence d’indice d’octane élevé. En combinant ce catalyseur avec des procédés classiques, il est possible de transformer le gaz naturel et/ou le charbon soit en essence, soit en oléfines légères pour l’industrie chimique, soit en gasoil. Bien que le prix des produits soit encore plus élevé que celui des mêmes produits obtenus par voie classique, l’existence de ces procédés a diminué la dépendance de beaucoup de pays industriels des pays exportateurs de pétrole.Enfin, la zéolite ZSM-5 dans sa forme acide est utilisée dans le procédé Mobil-Badger pour la production de l’éthylbenzène , produit intermédiaire dans la fabrication du styrène. Utilisant ce même catalyseur, le para-xylène, produit de base dans la fabrication de polyesters, peut être produit. Les propriétés caractéristiques de ces procédés sont leurs rendements élevés, leurs produits purs, l’absence de corrosion des matériaux et de pollution de l’environnement. À l’aide de la zéolite ZSM-5, les compagnies Mobil et Hoechst ont réussi à fabriquer un nouveau monomère: le para-méthylstyrène (PMS). Son polymère, le polypara-méthylstyrène (PPMS), a des qualités supérieures à celles du polystyrène.L’obtention des analogues synthétiques des zéolites naturelles et la découverte de nouvelles zéolites ont permis le développement récent d’études systématiques. Leurs propriétés caractéristiques sont si intéressantes qu’elles conduisent à une utilisation accrue des zéolites dans le domaine industriel.
Encyclopédie Universelle. 2012.
